Sergio Castro, Gerente General de Castro Ingeniería

CONCENTRACIÓN SALMUERAS DE LITIO
Etapa de evaporación:
Las salmueras de los salares contienen Litio, principalmente, como sulfato doble de Litio y Potasio (KLiSO4).
La calidad de una salmuera se mide por la concentración de Li, por la razón Mg/Li, y por el contenido de impurezas de Boro.
El método convencional de concentración es por evaporación solar. El proceso se basa en saturar la salmuera hasta lograr su cristalización fraccionada, aprovechando la distinta solubilidad de sus sales (Fig. 1).
La etapa de evaporación busca concentrar el Li desde aproximadamente 0.1% hasta 4.5 a 6.0%, lo cual toma entre 12 a 18 meses. Se estima que, durante este proceso se evapora sobre el 95% del agua presente en la salmuera original.
El proceso se inicia extrayendo la salmuera desde la profundidad del salar, y disponiéndola en una poza poco profunda (aproximadamente de 600 x 800 m y 1.5 m de profundidad). A medida que se evapora el agua, la salmuera se satura y comienzan a cristalizar las primeras sales. Ahora la salmuera se transfiere a una segunda poza, donde cristalizan otras sales; y así sucesivamente, de manera que la salmuera atraviesa un total de 6 pozas.
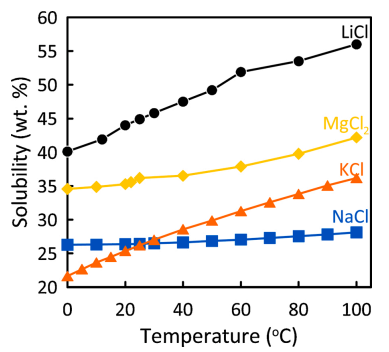
Figura 1. Solubilidad de sales presentes en salmueras de Li en función de la temperatura (Cerda et al., 2021).
El objetivo es llegar a una solución concentrada de Litio (cloruro de Li), más ciertas impurezas que no cristalizan por saturación.
En las pozas tiene lugar la cristalización fraccionada de las siguientes sales: primero la Halita (NaCl) (poza 1); enseguida la Silvinita (KCl+NaCl) (poza 2); la Silvita (KCl) (poza 3); la Carnalita (KCl. MgCl2.6H2O) (poza 4); la Bischofita (MgCl2.6H2O) (poza 5). Cuando la concentración de la salmuera es alta, ocurre la precipitación de la Carnalita de litio (LiCl-MgCl2·7H2O) (poza 6), disminuyendo el rendimiento del proceso. Se recomienda lixiviar la carnalita con salmuera fresca, o con cloruro de Mg, para recuperar parte del Li precipitado.
Las sales cristalizadas se retiran de las pozas y constituyen sub-productos del proceso (p.ej., la Bischofita se utiliza como supresor de polvos en caminos de tierra).
Finalmente, la salmuera puede alcanzar alrededor de 5,8% Li, 20% Mg y 0.7% B (expresado como ácido bórico (H3BO3)), y será la base para iniciar la etapa de purificación.
PURIFICACIÓN QUÍMICA DE LITIO
La salmuera resultante de la etapa de evaporación se traslada a una planta química para realizar su purificación, y obtener el producto comercial carbonato de Li grado técnico (99.5%). También, se puede obtener hidróxido de Li (LiOH), o cloruro de Li (LiCl), pero por vías diferentes.
Etapa de remoción de impurezas
Antes de iniciar la obtención del carbonato de litio (Li2CO3), se debe eliminar una serie de impurezas que aún permanecen en la salmuera. Ellas son, principalmente, Boro, Magnesio y Calcio.
Una vez concluida la etapa de evaporación (con una concentración de 5.5-6.0% Li), lo primero es minimizar el contenido de Boro, para lo cual, se aplica, ya sea, una etapa de extracción por solventes (SX), o de extracción por resinas de intercambio iónico. En seguida, mediante un procedimiento químico en 2 etapas se eliminan las impurezas residuales de Mg y Ca. Para ello, primero se agrega carbonato de sodio o ceniza de soda (Na2CO3-Na2SO4), para precipitar el Mg como MgCO3, y el Ca como CaCO3 y CaSO4 (Fig. 2). Las reacciones son las siguientes:
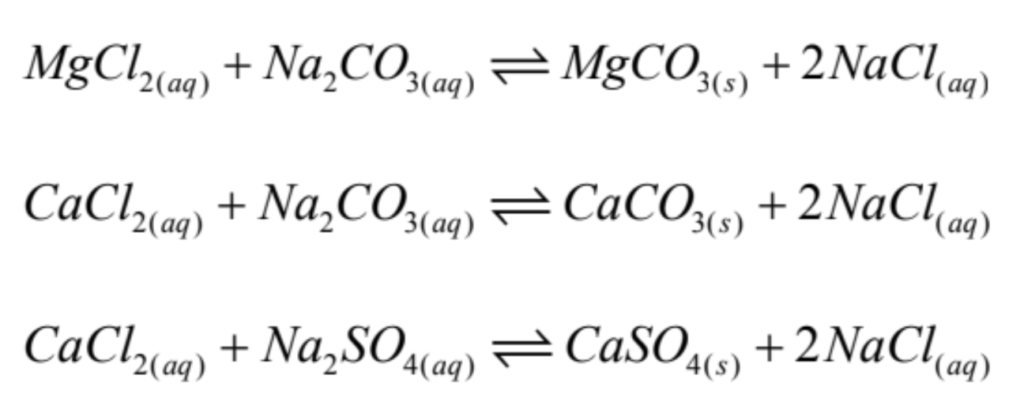
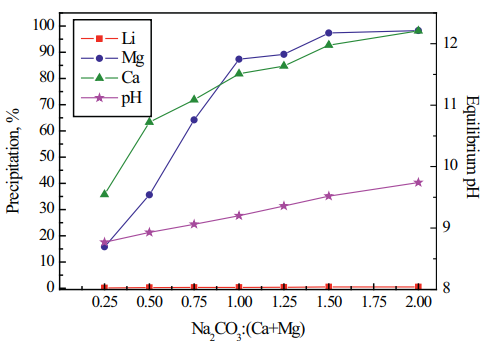
Figura 2. Efecto del carbonato de sodio (razón Na2CO3/(Ca+Mg)) sobre la precipitación de los carbonatos de Ca y Mg, a 25°C y 30 min (Zhang et al., 2023).
En una segunda etapa, se termina de precipitar el Mg remanente (disuelto como cloruro y sulfato de Mg), con lechada de cal, para formar hidróxido de Mg ((Mg(OH)2). Se advierte que este precipitado es coloidal y de difícil separación por filtración. Las reacciones son las siguientes:
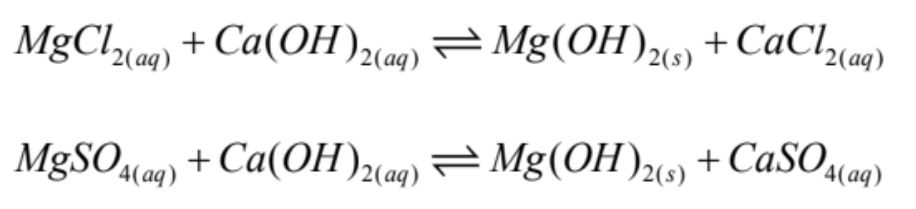
Para salmueras con alto contenido de Mg, se recomienda su eliminación temprana, antes de la etapa de evaporación, lo cual también se realiza por precipitación de hidróxido de Magnesio con lechada de cal.
Etapa de carbonatación
Se denomina carbonatación a la etapa de obtención del producto carbonato de litio (Li2CO3). Esta tapa aprovecha la baja solubilidad del carbonato de Litio a altas temperaturas, de manera que al calentar soluciones acuosas saturadas se favorece su cristalización como Li2CO3 (Fig. 3).
La precipitación de carbonato de litio con ceniza de soda se lleva a cabo a una temperatura entre 90-95°C, aprovechando la baja solubilidad del carbonato de Litio a alta temperatura (Fig. 3). La reacción es la siguiente:
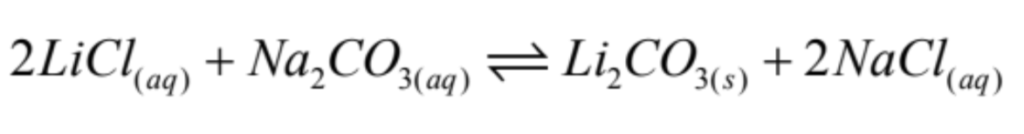
El carbonato de litio precipitado es sedimentado y filtrado en caliente para luego ser lavado con agua caliente desmineralizada. Se obtiene un queque filtrado que se seca a una temperatura de entre 130 a 160 °C; y luego es envasado como producto comercial, de manera higroscópica, alcanzando una pureza superior al 99% de Li2CO3, pero que aún contiene impurezas (entre ellas Boro).
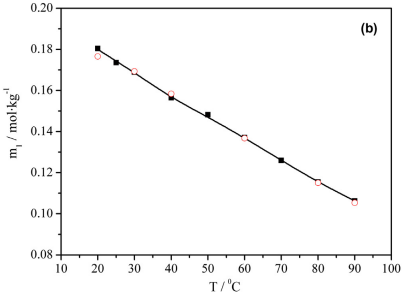
Figura 3. Solubilidad del carbonato de litio en agua en función de la temperatura (Cheng et al, 2013).
Después de filtrar el carbonato de litio se genera una solución sobrenadante de baja concentración en Litio, denominada licor madre, que se recircula al proceso.
Etapa de purificación
Esta es la última etapa del proceso y consiste en obtener carbonato de Li (Li2CO3) grado-batería (99.9% pureza), a partir del carbonato de Li grado técnico.
El método es por re-cristalización.
Se inicia con la disolución del carbonato de Li por reacción con CO2 gaseoso en medio acuoso, para convertirlo en bicarbonato de Litio soluble (LiHCO3). La reacción es la siguiente:
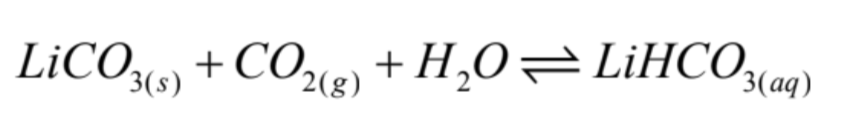
Esta reacción se favorece a baja temperatura y alta presión de CO2, dado que ambos factores aumentan la solubilidad del CO2 en agua (Fig. 4).
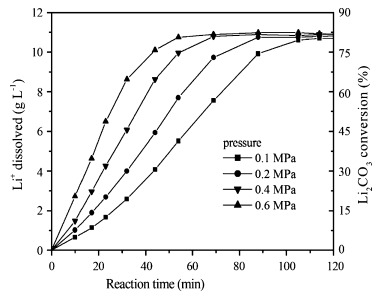
Figura 4. Efecto de la presión de CO2 sobre la disolución del carbonato de Li (2.95 L/min CO2) (Yi et al., 2007).
En estas condiciones, las impurezas precipitan o se disuelven. Las primeras se separan por filtración, mientras que las solubles se deben eliminar mediante resinas de intercambio iónico, o extracción por solventes. Una vez purificada la solución de bicarbonato de Li, se aplica calor para descomponerlo térmicamente, a 90-100°C, condiciones bajo las cuales re-cristaliza el carbonato de Li, y aplicando vacío se puede recuperar el CO2 (puede ser reciclado) (Fig. 5).
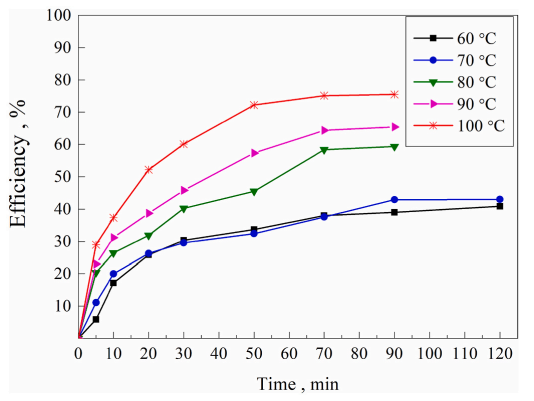
Figura 5. Eficiencia de precipitación del carbonato de litio desde soluciones de LiHCO3 (5.72g/L de Li), en función de la temperatura y el tiempo (Zhang et al., 2023).
El carbonato de Li resultante es un producto comercial de alta pureza, y satisface los estándares de grado-batería. La reacción es la siguiente:
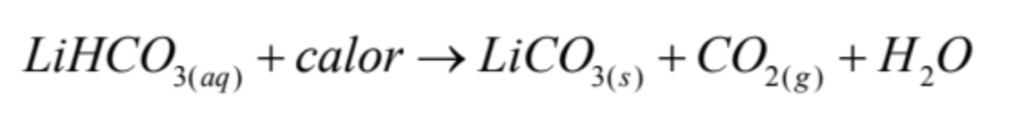
Si se trabaja a alta presión de CO2 se produce más fácilmente la disolución del carbonato de Litio.
Referencias
Cerda et al., 2021. Recovering water from lithium-rich brines by a fractionation process based on membrane, distillation-crystallization. J. of water Process Engineering, 41, 102063.
Zhang et al., 2023. A new process to produce battery grade lithium carbonate from salt lake brines by purification, synergistic solvent extraction and carbón dioxide stripping. Hydrometallurgy, 215, 105991.
Cheng et al, 2013. Solubility of Li2CO3 in Na–K–Li–Cl brines from 20 to 90 °C. J. Chem. Thermodynamics, 67, 74-82.
Yi et al., 2007. Refining of crude Li2CO3 via slurry phase dissolution using CO2. Separation and Purification Technology, 56, 241-248.






